Líneas espectrales: tras la huella de los átomos

Cuando miramos la luz de una farola (lámpara de sodio) en la calle, notamos un color amarillo intenso. Si pudiéramos descomponer esa luz con un espectroscopio, veríamos que no se trata de un arco iris continuo, sino de un par de líneas muy definidas: el “amarillo doble” del sodio. Del mismo modo, cuando miramos al cielo nocturno, la estrella Betelgeuse brilla con un rojo intenso. Ese color no es casual: en su espectro aparecen líneas características que revelan la abundancia de hidrógeno y de elementos más pesados como el oxígeno y el hierro. Sin necesidad de viajar hasta allí, la luz nos trae su composición. De forma similar, si analizamos la luz del Sol encontramos miles de líneas oscuras en su espectro, llamadas líneas de Fraunhofer.
Estas marcas son mucho más que curiosidades ópticas: son la "huella digital" de los átomos, son las denominadas líneas espectrales, un código con el que la materia firma su presencia, y que nos permite identificar la composición de los objetos.
¿Qué son las líneas espectrales?
Un átomo no emite ni absorbe luz de manera arbitraria. La energía potencial de un electrón en un átomo se considera negativa si se compara con el estado en el que el electrón está infinitamente alejado del núcleo, y su valor se incrementa (en sentido menos negativo) a medida que aumenta la distancia entre el electrón y el núcleo. En el contexto de la mecánica cuántica, un electrón “ligado” no puede asumir cualquier valor de energía, sino solo aquellos que corresponden a un conjunto discreto de estados (o niveles) centrados alrededor del núcleo. La explicación teórica de estos estados y sus energías se encuentra en la ecuación de Schrödinger independiente del tiempo, que describe cómo la función de onda electrónica se distribuye en el espacio y qué valores de energía son posibles.
Cada nivel de energía puede medirse mediante la energía que se requiere para desligar al electrón de su átomo, y esta cantidad suele expresarse en electronvoltios (eV). El nivel de menor energía se llama estado fundamental, y los niveles más elevados son los estados excitados. Al ascender a un nivel superior, la distancia promedio del electrón al núcleo generalmente aumenta, elevando también su energía. No obstante, además del número cuántico principal (n), los niveles de energía pueden depender de otros números cuánticos como el momento angular (l), en virtud de las interacciones entre electrones y de fenómenos como el acoplamiento espín–órbita.
Cuando un electrón salta entre dos estados de energía, se produce la absorción o emisión de un fotón cuya energía corresponde a la diferencia entre los niveles. Esta transición puede explicarse mediante el modelo de Bohr y se calcula con mayor precisión usando la ecuación de Schrödinger. Por tanto, los cambios de estado suceden de manera puntual, con “saltos” parecidos al comportamiento de partículas: un único fotón desencadena la transición de un solo electrón. Puesto que la energía del fotón es proporcional a su frecuencia, estas diferencias de energía se manifiestan como líneas espectrales bien definidas en el espectro electromagnético. Cada elemento químico posee un espectro característico condicionado por la carga nuclear, la configuración electrónica y las interacciones entre electrones.
Por lo tanto, como los electrones solo pueden ocupar ciertos niveles de energía, y al saltar de uno a otro emiten o absorben un fotón con una energía (y por tanto una frecuencia y un color) muy específicos.
El resultado son:
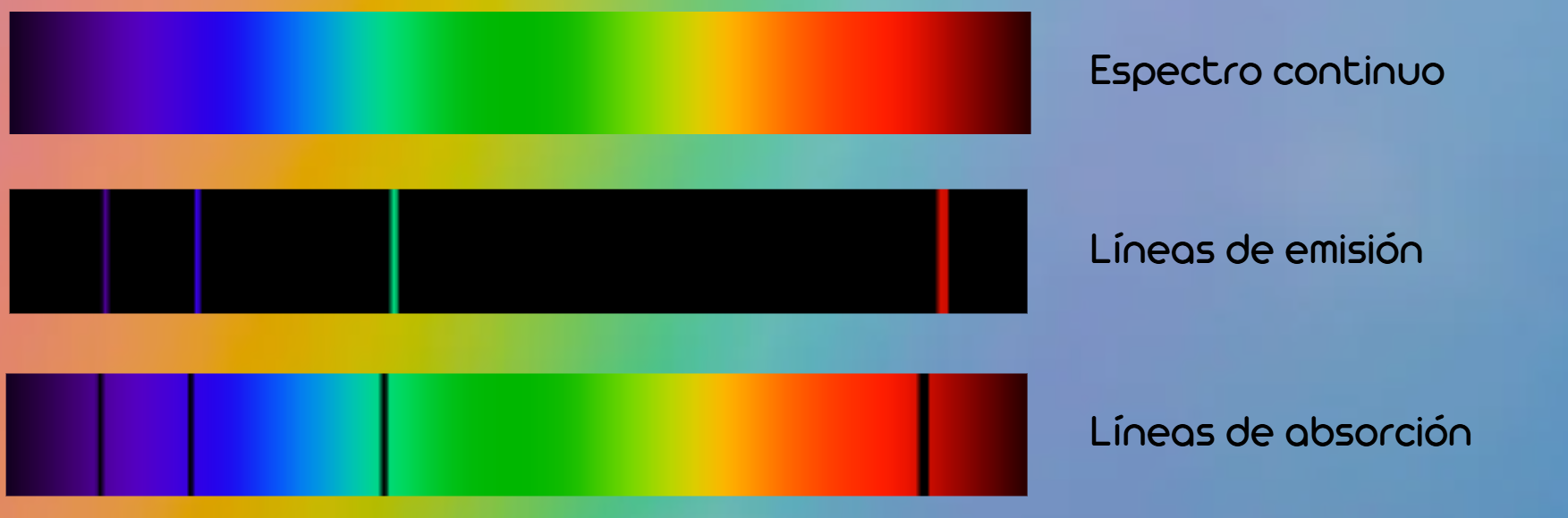
- Líneas de emisión: aparecen brillantes sobre un fondo oscuro cuando un átomo emite luz a frecuencias concretas.
- Líneas de absorción: aparecen oscuras sobre un espectro continuo cuando los átomos absorben fotones en esas frecuencias exactas.
En ambos casos, cada elemento químico tiene un patrón único de líneas: su “código de barras espectral”.
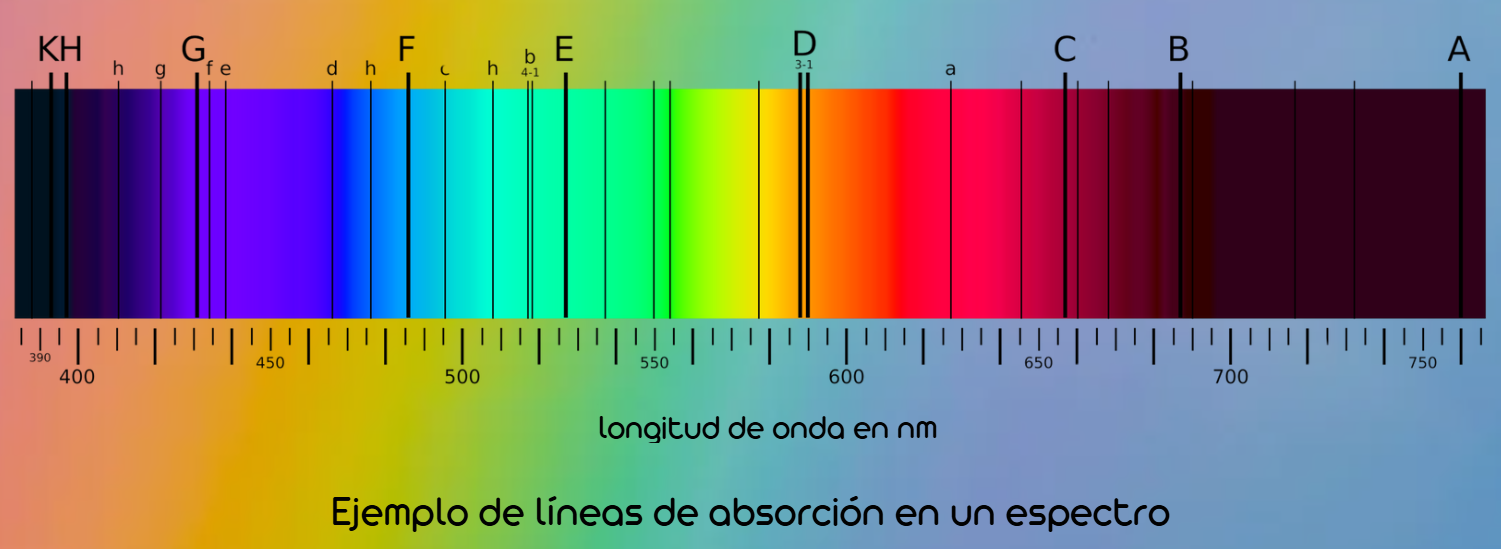
En un experimento de espectroscopia, si un haz de radiación continua atraviesa un gas o un plasma, los átomos pueden absorber aquellos fotones cuya energía sea la justa para excitar los electrones. Posteriormente, estos electrones regresan a estados más bajos y reemiten la energía en todas direcciones, lo que genera líneas de absorción visibles como bandas oscuras cuando se observa el espectro de salida. Si en cambio, se detecta únicamente la radiación emitida por el gas (sin la fuente de fondo), se registran las líneas de emisión propias de cada transición electrónica. Las mediciones espectroscópicas de la posición, intensidad y anchura de estas líneas permiten averiguar la composición química y ciertas propiedades físicas de la muestra analizada.
Al examinar con detalle estas líneas, pueden aparecer estructuras finas debidas al acoplamiento espín–órbita, que mezcla la orientación del espín del electrón con su movimiento orbital alrededor del núcleo. Además, cuando un átomo se coloca en un campo magnético externo, la interacción con el momento magnético del átomo y sus electrones hace que los niveles de energía se desdoblen, produciendo varias líneas espectrales cercanas entre sí: este fenómeno se llama efecto Zeeman. De igual manera, un campo eléctrico externo puede modificar los niveles de energía del átomo y originar el efecto Stark, que también produce el desplazamiento o desdoblamiento de las líneas.
Por otro lado, si un electrón se encuentra en un estado excitado y aparece un fotón adicional con la misma energía que la diferencia entre el nivel excitado y uno más bajo, puede ocurrir la emisión estimulada: el electrón desciende de nivel y emite un segundo fotón con la misma fase y dirección que el fotón incidente, resultando en dos fotones coherentes. Este principio se explota en los láseres, que generan un haz de luz muy intenso y coherente, concentrado en una banda de frecuencias estrecha.
En conjunto, todos estos fenómenos —niveles de energía discretos, absorción y emisión de fotones, la estructura fina, la interacción con campos externos y la emisión estimulada— componen un panorama detallado de la física atómica y ofrecen las claves para entender la diversidad de líneas espectrales, así como para desarrollar múltiples aplicaciones tecnológicas en ámbitos como la espectroscopia, la electrónica y la óptica cuántica.

De Fraunhofer a la astrofísica moderna
A comienzos del siglo XIX, Joseph von Fraunhofer observó cientos de líneas oscuras en el espectro solar. No sabía aún su origen, pero sentó las bases de la espectroscopia. Décadas después, Kirchhoff y Bunsen descifraron el misterio: esas líneas correspondían a la absorción de elementos químicos en la atmósfera del Sol. Desde entonces, la espectroscopia se convirtió en un lenguaje universal para leer la composición de las estrellas y del cosmos.
Para qué sirven las líneas espectrales
- Astronomía: nos permiten saber de qué están hechas las estrellas, la temperatura de un plasma, la velocidad de galaxias (efecto Doppler) o la presencia de exoplanetas.
- Física nuclear y de plasmas: diagnóstico del estado de un reactor de fusión o de un plasma en laboratorio.
- Química y biología: técnicas como la espectroscopía infrarroja o Raman permiten identificar compuestos.
- Tecnología cotidiana: pantallas, láseres, iluminación LED, análisis forense de materiales.
En la práctica, las líneas espectrales no son infinitamente finas: se ensanchan debido a distintos efectos. El movimiento térmico de los átomos produce ensanchamiento Doppler, mientras que las interacciones con campos eléctricos y magnéticos generan ensanchamientos Stark y Zeeman. Estos detalles, lejos de ser un inconveniente, aportan información extra sobre la densidad, la temperatura y el entorno en el que se encuentra la materia.
Cada línea espectral es un mensaje de la naturaleza. Gracias a ellas podemos leer la composición de una estrella a años luz de distancia, o analizar con precisión un plasma de fusión en la Tierra. La próxima vez que veas un arco iris o el resplandor de una lámpara, piensa que detrás de esos colores se esconde un alfabeto secreto que los científicos llevan más de dos siglos descifrando.





